METABOLISMO MICROBIANO (Capitulo 6)
PARTICIPACIÓN
DEL METABOLISMO EN LA BIOSÍNTESIS Y CRECIMIENTO
El crecimiento microbiano requiere la polimerización
de bloques bioquímicos de construcción para dar origen a proteínas, ácidos nucleicos,
polisacáridos y lípidos. El metabolismo microbiano puede dividirse en cuatro categorías generales:
1) vías para la interconversión de metabolitos focales;
2) vías de asimilación para la formación de metabolitos focales;
3) secuencias biosintéticas para la conversión de metabolitos focales a productos terminales, y
4) vías que producen energía metabólica para crecimiento y mantenimiento.
METABOLITOS
FOCALES Y SU INTERCONVERSIÓN
- Interconversiones de glucosa 6-fosfato y carbohidratos
Los carbohidratos poseen la fórmula empírica (CH2 O) n
y el objetivo primario del metabolismo de los carbohidratos es modificar n, es
decir, la longitud de la cadena de carbonos. El mecanismo por el cual la
longitud de la cadena de fosfatos de carbohidrato se interconvierte, En un caso
se utilizan reacciones de oxidación para eliminar un carbono de la molécula de
glucosa 6-fosfato, produciendo un derivado pentosa, la ribulosa 5-fosfato. Las
reacciones de isomerasa y epimerasa transforman las formas bioquímicas más
comunes de las pentosas: ribulosa 5-fosfato, ribosa 5-fosfato y xilulosa 5-fosfato.
Las transcetolasas transfieren un fragmento de los carbonos de una molécula
donadora a una aceptora.
- Formación y utilización de fosfoenolpiruvato
Las moléculas de triosa-fosfato se forman por la
interconversión de fosfoésteres de carbohidrato y sufren interconversión a
fosfoenolpiruvato por una serie de reacciones que se muestran en la fi gura
6-7. La oxidación de gliceraldehído 3-fosfato por NAD+ se acompaña de la
formación de enlaces anhídrido en uno de los carbonos de la molécula de
1,3-difosfoglicerato. Este anhídrido de fosfato se transfiere en una
fosforilación de sustrato a ADP, dando origen a enlaces ricos en energía en el
ATP.
- Formación y utilización de oxaloacetato
Como se describió antes, muchos organismos producen
oxaloacetato por una carboxilación de piruvato dependiente de ATP. Otros
organismos, como E. coli, que forman fosfoenolpiruvato directamente a partir de
piruvato, sintetizan oxaloacetato por carboxilación de fosfoenolpiruvato. La
succinil-CoA es necesaria como precursor biosintético para la síntesis de porfirinas
y de otros compuestos esenciales. Algunos organismos forman succinil-CoA por la
reducción de oxaloacetato a través de malato y fumarato. Estas reacciones
representan un flujo metabólico invertido que se observa en el ciclo del ácido
tricarboxílico.
- Formación de cetoglutarato 𝛂 a partir de piruvato
Las conversiones de piruvato a cetoglutarato α requieren de una vía metabólica que diverge y más
tarde converge. En una vía, se forma oxaloacetato por carboxilación de piruvato
o fosfoenolpiruvato. En la otra vía, se oxida el piruvato a acetilCoA. Cabe
hacer notar que, sin importar el mecanismo enzimático utilizado para la
formación de oxaloacetato, se necesita acetil-CoA como efector metabólico
positivo para este proceso. Así, la síntesis de oxaloacetato se equilibra con
la producción de acetil-CoA.
VÍAS
DE ASIMILACIÓN
- Crecimiento con acetato
El acetato se
metaboliza a través de acetil-CoA, y muchos organismos poseen la capacidad de
formar acetil-CoA (fi g. 6-9). La molécula de acetil-CoA se utiliza para la
biosíntesis de cetoglutarato α y en la mayor parte de los organismos con mecanismos
respiratorios, los fragmentos acetilo de acetil-CoA sufren oxidación completa a
dióxido de carbono a través del ciclo de los ácidos tricarboxílicos (fi g.
6-10). La capacidad de utilizar acetato como fuente neta de carbono se limita a
unos cuantos microorganismos y plantas.
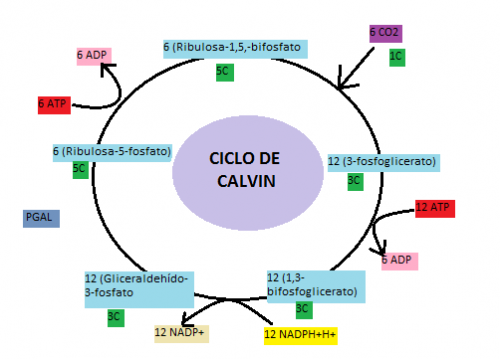
- Crecimiento con dióxido de carbono: ciclo de Calvin
Al igual que las plantas y algas, varias especies
microbianas pueden utilizar dióxido de carbono como única fuente de carbono. En
casi todos estos organismos, la vía primaria de asimilación de carbono es a
través del ciclo de Calvin, en el cual el dióxido de carbono y difosfato de
ribulosa se combinan para formar dos moléculas de 3-fosfoglicerato. El
3-fosfoglicerato sufre fosforilación a 1,3-difosfoglicerato y este compuesto se
reduce a gliceraldehído 3-fosfato, un derivado triosa.
- Despolimerasas
- Oxigenasas
- Vías de reducción
Algunos microorganismos viven en entornos
extremadamente reductores que favorecen reacciones químicas que no ocurrirían
en organismos que utilizan oxígeno como aceptor de electrones. En estos
organismos, pueden utilizarse reductores potentes para favorecer reacciones que
permitan la asimilación de compuestos relativamente intratables. Un ejemplo es
la asimilación por reducción del benzoato, un proceso en el cual el anillo aromático
sufre reducción y se rompen sus enlaces para dar origen a pimelato de ácido
dicarboxílico. Reacciones metabólicas adicionales
convierten el pimelato a metabolitos focales.
- Asimilación de nitrógeno
| Mecanismo para la asimilacion de NH3. |
PATRONES
MICROBIANOS DEL METABOLISMO PARA LA PRODUCCIÓN DE ENERGÍA
Hay dos mecanismos metabólicos principales para la
generación de enlaces de pirofosfato ácido ricos en energía en el ATP:
fosforilación del sustrato (transferencia directa de enlaces de fosfato
anhídrido a partir de un donador orgánico para el ADP) y la fosforilación de
ADP por un fosfato inorgánico. Esta última reacción es desfavorable desde el
punto de vista energético y debe ser estimulada por un gradiente electroquímico
transmembrana, la fuerza motriz protónica.
VIAS DE FERMENTACION.
A. Estrategias
para la fosforilación del sustrato
En ausencia de
respiración o de fotosíntesis, las células dependen por completo de la
fosforilación de sustrato para la producción de energía: la generación de ATP
debe acoplarse con modificaciones químicas de compuestos orgánicos. Muchos
compuestos pueden actuar como sustratos fermentables y para su fermentación
varias vías han evolucionado.
B. Fermentación
de la glucosa
La diversidad
de las vías de fermentación se ilustra al tomar en consideración algunos de los
mecanismos utilizados por los microorganismos para lograr la fosforilación del
sustrato a expensas de la glucosa. En principio, la fosforilación de ADP a ATP
puede acoplarse para alguna de dos transformaciones químicas equilibradas.
C. Vía
de Embden-Meyerhof
Esta vía que con frecuencia se encuentra como
mecanismo para la fermentación de la glucosa, utiliza una cinasa y una aldolasa
para transformar el fosfato de hexosa (C6 ) a dos moléculas de fosfato de
triosa (C3 ). Hay cuatro reacciones de fosforilación del sustrato que acompañan
la conversión de la triosa-fosfato a dos moléculas de piruvato.
D. Fermentaciones
de Entner-Doudoroff y de heterolactato
Las vías
alternativas para la fermentación de glucosa incluyen algunas acciones
enzimáticas especializadas. La vía de Entner-Doudoroff difiere de otras vías
del metabolismo de carbohidratos por una deshidratación de 6-fosfogluconato
seguido de una reacción de aldolasa que produce piruvato y triosa-fosfato. La
fermentación de heterolactato y algunas otras vías de fermentación dependen de
una reacción de fosfocetolasa que produce el desdoblamiento fosforolítico de
cetosafosfato para producir acetil fosfato y triosa-fosfato.
E. Variaciones
adicionales en la fermentación de carbohidratos
Las vías para
la fermentación de carbohidratos pueden dar cabida a diversos sustratos que se
describen a continuación y los productos terminales pueden ser más diversos de
lo que podría sugerirse. Por ejemplo, hay numerosos mecanismos para la
oxidación de NADH a expensas de piruvato.
F. Fermentación
de otros sustratos
Los carbohidratos son el único sustrato susceptible de
fermentación. El metabolismo de aminoácidos, purinas y pirimidinas origen a
fosfato de carbamoilo, que puede utilizarse para fosforilar el ADP a ATP.
Algunos organismos fermentan pares de aminoácidos, utilizando a uno como
donador de electrones en tanto que el otro actúa como aceptor.
Fotosíntesis
bacteriana
Los organismos
fotosintéticos utilizan energía luminosa para separar la carga electrónica,
crear reductores y oxidantes relacionados con la membrana como consecuencia de
un evento fotoquímico. La transferencia de electrones de reductores a oxidantes
crea una fuerza motriz protónica. Muchas bacterias llevan a cabo el metabolismo
fotosintético sin depender en lo absoluto del oxígeno. La energía luminosa se
utiliza como fuente de energía metabólica y el carbono para el crecimiento se
obtiene ya sea a partir de compuestos orgánicos (fotoheterótrofos) o a partir
de la combinación de reductores inorgánicos (p. ej., tiosulfato) y dióxido de
carbono (fotolitótrofos).
REGULACION DE LA ACTIVIDAD ENZIMATICA
A. Enzimas
como proteínas alostéricas
En muchos casos, la actividad de una enzima que
cataliza un paso metabólico temprano en la vía metabólica es inhibida por un
producto terminal de dicha vía. Sin embargo, tal inhibición no puede depender
de competencia por el sustrato enzimático porque la estructura del producto
terminal y el intermediario temprano (sustrato) por lo común son bastante
diferentes. La inhibición depende de la regulación enzimática alostérica: cada
enzima posee un sitio catalítico que se une al sustrato y además uno o más
sitios que se unen a moléculas reguladoras pequeñas, conocidas como efectores.
B. Inhibición
por retroalimentación
El mecanismo general por el cual ha
evolucionado en los microorganismos la regulación del flujo de carbono a través
de vías biosintéticas es el más eficiente que se pueda imaginar. El producto
terminal en cada caso produce inhibición alostérica de la actividad de la
primera (y sólo de la primera) enzima en la vía metabólica. Por ejemplo, el
primer paso en la biosíntesis de isoleucina, que no implica ninguna otra vía,
es la conversión de l-treonina a ácido cetobutírico α, que es catalizada por la treonina desaminasa. La
treonina desaminasa es inhibida de manera específica y alostérica por la
l-isoleucina y por ningún otro compuesto; las otras cuatro enzimas de la vía no
se ven afectadas (aunque su síntesis puede verse reprimida).
C. Activación
alostérica
En algunos casos es ventajoso para la célula y para un
producto terminal o producto intermedio activar en lugar de inhibir una enzima
en particular. En el desdoblamiento de la glucosa por E. coli, por ejemplo, la
producción excesiva del intermediario glucosa 6-fosfato y fosfoenolpiruvato
ocasiona la desviación de algunas moléculas de glucosa a la vía de síntesis de
glucógeno; esto se realiza por la activación alostérica de la enzima que
convierte las moléculas de glucosa 1-fosfato a ADP-glucosa.
D. Cooperatividad
Muchas enzimas
oligoméricas poseen más de un sitio de unión al sustrato y muestran
interacciones cooperativas de las moléculas de sustrato. La unión del sustrato
con un sitio catalítico incrementa la afinidad de los otros sitios para
moléculas adicionales de sustrato. El efecto neto de esta interacción es
producir un incremento exponencial en la actividad catalítica en respuesta al
incremento aritmético en la concentración de sustrato.
E. Modificación
covalente de las enzimas
Las propiedades
reguladoras de algunas enzimas se alteran por modificaciones covalentes de la
proteína. Por ejemplo, la respuesta de la glutamina sintetiza a los efectores
metabólicos se altera por la adenililación, la unión covalente de ATP a una
cadena lateral específica de tirosilo con cada subunidad enzimática. Las
enzimas que controlan la adenililación también se controlan por modificaciones
covalentes. La actividad de otras enzimas se altera por su fosforilación.
F. Desactivación enzimática: La actividad de algunas enzimas se elimina por medio
de su hidrólisis. El proceso puede ser regulado y en ocasiones señalado por
modificaciones covalentes de las enzimas dirigidas para la eliminación.


Comentarios
Publicar un comentario